微创介入治疗由内镜或影像导航经皮穿刺或打孔,对肿瘤病灶进行识别,并利用超声、激光、射频和微波等辐照,定点清除肿瘤,具有不开腹腔、创伤小、并发症少、术后恢复快和适应范围广等诸多优势,近年来引起了国际上医学界的高度重视。恶性肿瘤常呈浸润性生长,边界不清,导致一部分健康组织被切除,造成术后一定的后遗症和功能障碍。而且,卵巢癌和胃癌等肿瘤的生长部位隐秘,很多患者在确诊时已发生盆腹腔转移或淋巴结转移而处于晚期。超越局部及区域转移性肿瘤难以通过手术治愈,导致术后残留或复发。因此,如何精确定位肿瘤、准确识别肿瘤边界和判断淋巴结转移以实现微小肿瘤的精确诊疗一直是国际上具有挑战性的难题。
1、癌症的微波消融
微波消融是将电磁波能量转化为热能,通过热消融杀死肿瘤细胞。它具有简单方便、无创或微创、安全性好以及价格相对便宜等很多优点。然而,在治疗过程中有时也会不可避免的对正常组织造成损伤。为了实现肿瘤的高效、靶向治疗,亟需研究一种能应用于临床的微波增敏材料。

利用临床上广为应用的脂质体作为载体材料,携带具有很好微波增敏效果的高浓度无机盐,得到一种具有良好微波增敏效果的脂质体。由于长期的临床应用已经证明脂质体纳米载体具有良好的生物安全性,因此具有良好微波增敏效果的脂质体将在癌症治疗等领域具有广阔的临床应用前景。
为了实现微波介导的热化疗,提高疗效和克服肿瘤细胞的耐药性,实验室进一步利用温敏脂质体同时装载氯化钠和阿霉素。当脂质体到达肿瘤组织后,利用微波定点照射,温度升高导致脂质体破裂,药物快速释放出来,使肿瘤组织瞬间达到很高的药物浓度。通过热对化疗药物的增敏作用,可有效地杀死肿瘤细胞。
2. 高强度聚焦超声介导的癌症热化疗
高强度聚焦超声束(HIFU)可以在距波源一定距离的位置校准成一个毫米级面积的焦斑,对肿瘤位置进行较长时间的持续照射,可产生热消融和直接杀伤肿瘤所需的升温。与其它方法相比,HIFU作为一种定点刺激工具具有独特的优势,因为它可以传播到深部组织,也可以聚焦到特定的位置。
为了进一步提高HIFU治疗效果,本实验室制备了一种对HIFU和温度敏感的硅质体,并包埋水溶性或两亲性抗癌药物。该硅质体在血液循环过程中保持稳定,不会泄漏药物。当递送至肿瘤组织后,利用HIFU定点照射,产生惯性空化和温度升高,打开硅质体壳体,实现其装载药物的定点快速释放。温敏硅质体能保证只在需要治疗的指定区域内释放药物,不但增加了药物的局部浓度,提高了对病灶部位肿瘤细胞的杀伤力,达到最大的疗效,而且毒副作用最小,避免了全身给药对人体带来的伤害,同时,HIFU产生的热对释放出的药物还可起到增敏效果,可降低肿瘤细胞的耐药性。 这一直接针对肿瘤的非侵入式治疗方式处于攻克癌症研究的国际前沿,很有可能会产生可行的临床治疗策略。

3、癌症的可视化光动力治疗
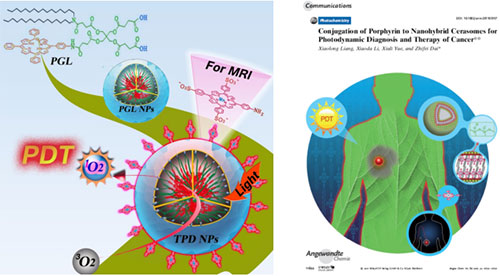
光动力疗法利用光敏剂在光照射下产生的单线态氧来杀伤肿瘤细胞,具有创伤小、毒性低、选择性高、适用性好等众多优点。但是,由于缺乏理想的光敏剂,制约了光动力疗法在临床上更广泛的应用。目前常用的光敏剂大多数呈疏水性,在生理条件下容易聚集,导致荧光淬灭,光动力疗效大幅下降。用脂质体包埋光敏剂可以改善其水溶性,提高生物相溶性。但是,由于脂质体的稳定性差,载药量低(通常低于10%),容易泄漏,从而使疗效降低,并导致较严重的光毒副作用。为了解决这些问题,课题组摒弃了目前通用的物理包埋方法,将卟啉分子通过共价键直接连接到复合脂质分子上,合成了含有卟啉的复合脂质,并以此为原料制备了卟啉硅质体,光敏剂载药量可达33%以上。在卟啉硅质体中,每个卟啉分子被两条脂肪长链隔开,阻止了卟啉分子的聚集,从根本上避免了用脂质体直接包埋光敏剂时产生的自淬灭效应,显著提高了荧光量子产率。由于卟啉硅质体能发出很强的荧光,因此可作为荧光探针。而且,将一定比例的卟啉与锰离子配位得到锰卟啉,可以增强T1加权的磁共振信号。
由于卟啉分子通过共价键固定在硅质体的脂质双层中,避免了光敏剂的释放,使得卟啉硅质体比卟啉脂质体具有更高的单线态氧量子产率,增强了对癌细胞的杀伤力。此外,还可以进一步使用卟啉硅质体携带其它化疗药物,对癌症进行光动力治疗与化疗的综合治疗。因此,卟啉硅质体可将癌症的荧光/磁共振双模态成像和光动力治疗两个过程融为一体。通过荧光/磁共振双模态成像对肿瘤进行精准定位,引导激光准确照射,实施定点清除,既可提高疗效,又可避免对正常组织的损伤,具有广阔的应用前景。
4、基于纳米金壳胶囊的癌症可视化光热治疗
光热治疗使用近红外光吸收剂和对于人体组织穿透力较强的红外光来使组织温度升高,选择性地杀死肿瘤细胞,而对正常细胞不造成伤害,是一种绿色治疗方法。然而,在进行光热治疗之前需要准确知道病变位置,在治疗过程中也需要实时监控治疗进程,在治疗完成后也需要尽快评价治疗效果以确定下一步治疗方案。这些诊断和监控的工作正好可以通过医学成像来完成。
将超声造影成像效果好的高分子微胶囊和用于光热治疗及CT成像的金纳米壳结合在一起,得到一种金纳米壳包覆的微胶囊复合材料。一方面,微胶囊超声造影剂可增强超声成像效果,通过超声成像和CT成像可确定肿瘤的尺寸和位置,监控治疗过程以及治疗后的恢复过程;另一方面,金纳米壳在近红外区有较强的吸收,经近红外光激发后,可将吸收的光能转化成热能,使局域范围内温度升高,有效地杀死恶性肿瘤细胞,对肿瘤进行光热治疗,并且还可以通过超声辐照进一步增加疗效。因此,通过金纳米壳胶囊可实现超声/CT双模态成像和光热治疗过程的完美结合,为开发先进的癌症诊断治疗技术提供了新的理念和方法。

5、基于聚吡咯纳米胶囊的癌症可视化光热治疗
通过聚乙二醇(PEG)将四氮十二环四乙酸钆(Ga-DOTA)连接到聚吡咯(PPy)纳米粒子的表面上成功地实现了磁共振/光声双模态成像引导下的癌症光热治疗。研究发现,所得到的Gd-PEG-PPy纳米粒子经过静脉注射后能够通过血液循环选择地富集在肿瘤部位。由于Gd-PEG-PPy纳米粒子在近红外区有很强的吸收和很高的光热转换效率,它不仅可以进行光热治疗,而且能显著增强光声成像效果。同时,Gd-PEG-PPy纳米粒子还可以使T1磁共振信号显著增强。由于磁共振成像和光声成像之间具有高度互补的特点,将这两种不同成像模态融合可以获得更多更全面的信息。因此,通过磁共振和光声双模态成像能使肿瘤组织和正常组织明显地区分开来,从而引导近红外激光准确照射肿瘤部位,使肿瘤组织温度升高,有效地杀死肿瘤细胞。两周后实现了肿瘤的完全消融,并且避免了对肿瘤周围正常组织的损伤。

6、双重靶向的癌症可视化光热治疗
分别合成了磁性普鲁士蓝纳米粒子(MPB)和近红外发光的CuInS2/ZnS(ZCIS)量子点。然后,将ZCIS量子点吸附到MPB的表面上,并用靶向肿瘤细胞表面黏附分子CD44的透明质酸(HA)进行修饰,得到多功能MPB@ZCIS@HA纳米粒子。体外和体内实验表明,MPB@ZCIS@HA可增强近红外荧光成像信号和降低磁共振T2加权成像的信号强度。在外加磁场下,MPB与透明质酸共同作用可以显著提高表达CD44的HeLa细胞对MPB@ZCIS@HA的摄取能力。活体荧光成像和磁共振成像表明,在双靶向的作用下,尾静脉注射入荷瘤裸鼠体内24小时后,MPB@ZCIS@HA即可大量聚集在肿瘤组织。在荧光成像和磁共振成像的引导下,利用近红外激光准确照射,对肿瘤部位进行光热治疗,肿瘤生长抑制率高达89.95%。