近期,北京大学工学院生物医学工程系戴志飞教授和北京大学附属第三医院超声科合作,设计合成了一种具有高度对称性的Janus药物共轭体,即两亲性氟尿苷-喜树碱共轭化合物(Janus Camptothecin-Floxuridine Conjugate, JCFC)(下图)。它以季戊四醇分子为骨架,利用对肿瘤微环境敏感的酯键,分别将两个疏水性的抗癌药物喜树碱分子与两个亲水性的抗癌药物氟尿苷分子连接在一起。该JCFC共轭化合物在极性溶剂中可自组装形成具有类似脂质体双层膜结构的纳米胶囊(NCs)。JCFC纳米胶囊的双层膜厚度大约为3.7 nm,载药量高达60%以上,远远大于传统脂质体的<10%,可在各种生理缓冲液中稳定分散,且可避免药物分子在循环过程中的泄漏。与游离的氟尿苷与喜树碱相比,JCFC NCs能够显著被癌细胞所摄取。最令人兴奋的是,静脉给药后,JCFC NCs可高效富集到达肿瘤部位,在酸性微环境和酯酶作用下,可以按照1:1的摩尔比释放抗癌药物氟尿苷与喜树碱,发挥出显著的协同治疗效果。
这是首次通过Janus药物共轭体制备具有类似脂质体结构的纳米胶囊用于联合药物的输送,为开发高效的药物输送体系提供了新的思路,这种策略也可有效应用于其他种类的抗癌药物。而且,JCFC纳米胶囊还可以用作载体来装载其它治疗或成像药物,实现癌症诊疗的一体化和个性化。相关论文在线发表在Advanced Materials(DOI: 10.1002/adma.201703135)上。梁晓龙博士和高闯为该文的共同第一作者, 戴志飞为通讯作者。
目前肿瘤化疗仍是大多数癌症患者不可缺少的治疗方法,但是化疗药物往往缺乏选择性,而且肿瘤细胞容易产生多药耐药性,从而严重影响了化疗的效果。因此,研究可逆转肿瘤多药耐药性的功能性药物输送系统在提高化疗药物药效、降低毒副作用等方面将具有良好的应用前景。纳米药物载体,如脂质体封装的抗癌药物在临床前和临床实验中已被证实能够通过降低毒性和增强疗效来提高治疗指数。然而,传统脂质体存在载药量低(一般<10%)、稳定性差、药物容易泄漏等问题,导致治疗效果不理想,并且容易引发机体的毒副作用。
由于肿瘤的异质性和耐药性问题,单独使用一种药物通常难以取得良好的治疗效果,因此人们一直致力于设计可以装载多种抗癌药物的纳米载体,通过协同治疗作用来提高治疗效果。相比于单一或连续给药,联合用药使癌细胞更不容易发展补偿性耐药机制。研究表明,抗癌药物组合无论是发挥协同作用还是拮抗作用,一般都依赖于联合用药中各化疗药物之间的摩尔比,特别是全身给药后控制肿瘤组织处不同药物的特定释放比例对疗效起着至关重要的影响。例如,CPX-1(注射用伊立替康/氟尿苷脂质体,1:1)对胃肠道瘤具有较高的协同治疗效果。
该文被WILEY出版集团列为亮点文章,报道在materialsviews China网站上。
链接:http://www.materialsviewschina.com/2017/12/27408/
原文:Janus药物共轭体:提高联合化疗效果的新思路 http://www.x-mol.com/med/news/11167
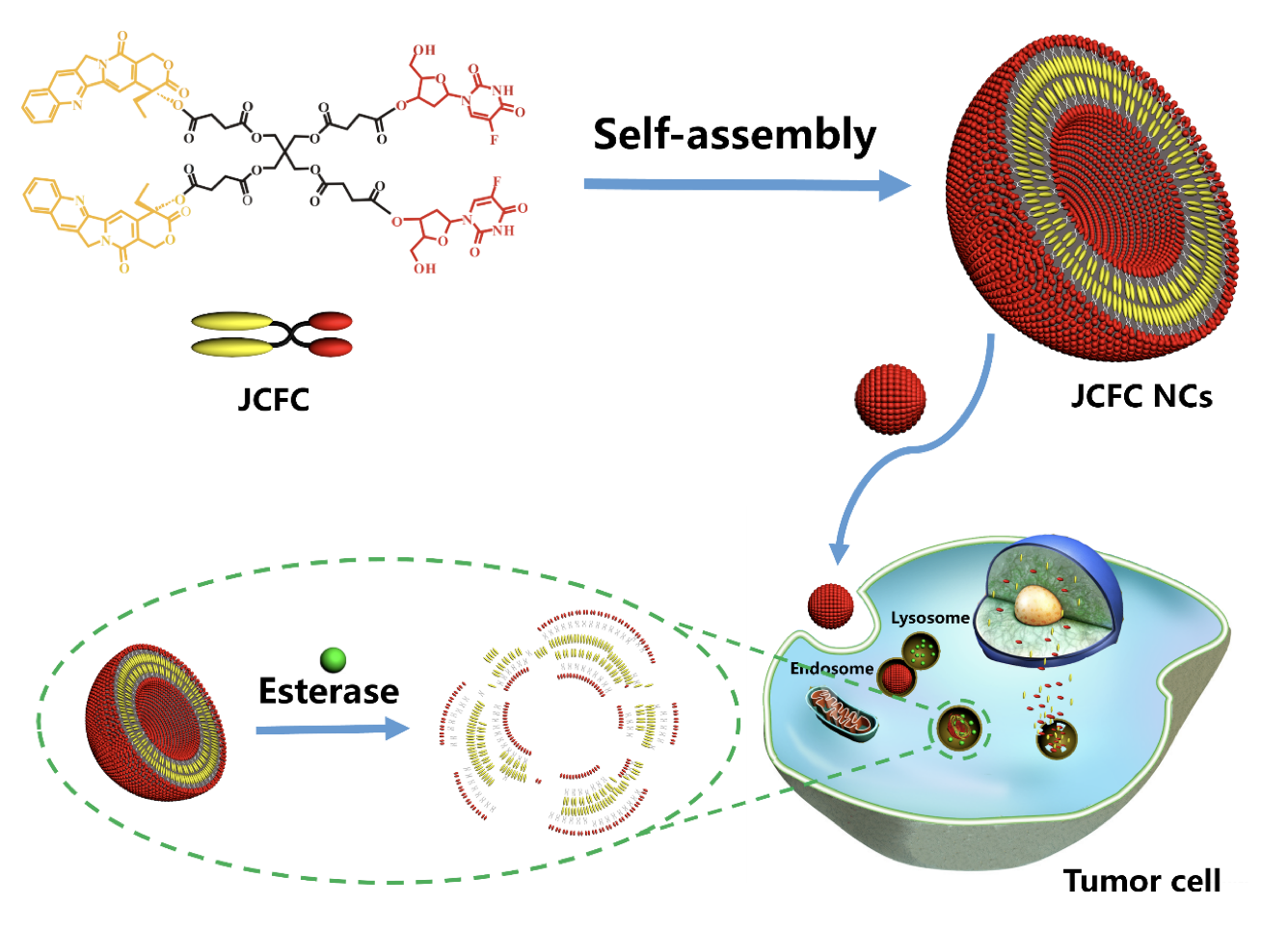
Abstract
The combination of camptothecin (CPT) and fluoropyrimidine derivatives acts synergistically at a 1:1 molar ratio. Practically, the greatest challenge is the development of a single liposomal formulation that can both encapsulate and maintain this drug combination at an exact 1:1 ratio to achieve coordinated pharmacokinetics. Consequently, a new type of liposome-like nanocapsule (NC) is developed from a highly symmetric Janus camptothecin–floxuridine conjugate (JCFC) amphiphile, which is synthesized by coupling two hydrophobic CPT molecules and two hydrophilic floxuridine (FUDR) molecules to multivalent pentaerythritol via a hydrolyzable ester linkage. JCFC NCs possess remarkably high drug-loading contents, and no premature release because of the highly stable co-delivery of the drug combination without the need for any carrier. It is shown that JCFC NCs consistently provide synergy and avoid antagonism in a broad panel of tumor cell lines. In vivo delivery of JCFC NCs leads to longer blood retention half-life, higher tumorous accumulation and cellular uptake of drugs, and greatly enhanced efficacy in murine tumor models compared to CPT, FUDR, and CPT + FUDR. This liposomal strategy can be extended to other hydrophilic and hydrophobic anticancer drugs that are coupled to pentaerythritol to self-assemble into nanocapsules for drug self-delivery, pointing to potential clinical translation in near future.
See full text: http://onlinelibrary.wiley.com/doi/10.1002/adma.201703135/epdf